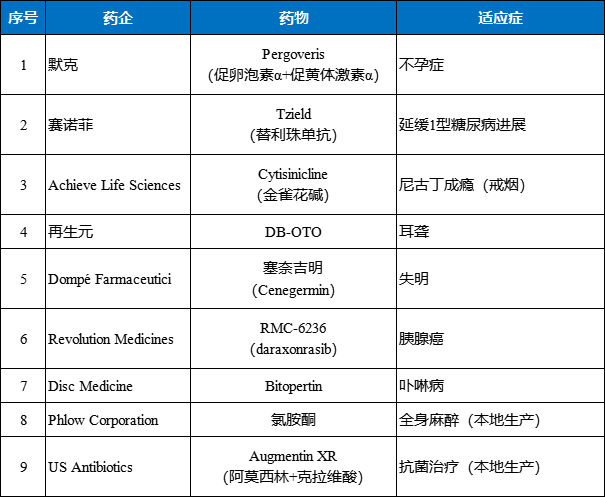
今年6月17日,FDA宣布推出专员国家优先审查代金券(CNPV)试点计划,旨在加快符合美国关键国家卫生优先事项的产品的药物审查流程,将审查时间从10-12个月缩短到仅1-2个月。近日,FDA公布了首批进入试点计划的“特批药物名单”,涉及9款药物。
首批进入FDACNPV试点计划的特批药物名单
Pergoveris(促卵泡素α+促黄体激素α)
Pergoveris是默克推出的一款复方药物,其中重组人促卵泡激素(FSH)和重组人促黄体生成素(LH)的组成比例为2:1,旨在模拟生殖生理学,支持女性卵泡发育直至排卵和成熟,从而帮助解决复杂的生育问题。该药物于2007年在欧洲获批上市,迄今为止已在74个国家和地区上市。
为扩大生育治疗机会,默克在美国和加拿大的医疗保健业务公司EMD Serono还在近日与美国政府达成了协议,为超过1000万难以生育的美国女性扩大获得其体外受精(IVF)疗法组合的使用范围。作为协议的一部分,EMD Serono将以大幅降低的价格向符合条件的处方患者提供Gonal-f(促卵泡激素α)、Ovidrel(绒毛膜促性腺激素α)和Cetrotide(注射用醋酸西曲瑞克)。当以上三种产品都应用于典型的试管婴儿方案时,患者将获得标价84%的折扣。
替利珠单抗(Teplizumab)
替利珠单抗是赛诺菲收购Provention Bio获得的一款CD3单抗,已在美国(商品名:Tzield)和中国(商品名:特瑞可)获批用于延缓8岁及以上儿童和成人1型糖尿病患者从2期进展至3期的速度。II期TN-10研究数据显示,仅仅一个14天疗程的替利珠单抗治疗就能够将患者的疾病进展时间推迟两年。近期,赛诺菲基于III期PROTECT研究的积极数据向FDA递交了替利珠单抗的补充生物制品许可申请(sBLA),用于延缓新诊断为1型糖尿病3期的8岁及以上儿童和成人患者的疾病继续进展的速度。该研究结果显示,两个12天疗程的替利珠单抗治疗可以显著降低患者的C肽(内源性胰岛素分泌的标志物,反映胰岛β细胞功能)水平的下降速度,并且有94.9%的患者维持了有临床意义的峰值C肽水平(≥0.2pmol/mL)。
Cytisinicline(金雀花碱)
Cytisinicline是Achieve Life Sciences推出的一款小分子药物,于2017年在欧洲获批上市(商品名:Tabex),用于治疗尼古丁成瘾(戒烟)。III期ORCA系列研究结果显示,在6周疗程内,Cytisinicline(3mg,每日3次)组对于尼古丁的连续戒断率显著高于安慰剂组(25.3% vs 4.4%),戒烟率也显著高于安慰剂组(14.8% vs 6.0%)。
DB-OTO
DB-OTO是再生元开发的一款基因疗法,旨在通过选择性增强携带耳畸蛋白(otoferlin,OTOF)编码基因突变患者的功能性OTOF表达水平,使耳朵能够将声音传递到大脑,从而促进听觉恢复。耳畸蛋白在内耳毛细胞的囊泡释放和信号转导方面起到重要作用。
I/II期CHORD研究数据显示,几乎所有(11/12)携带OTOF基因突变的重度遗传性听力损失患者在接受DB-OTO治疗后都实现了具有临床意义的听力改善,其中3例患者达到了正常听力水平。
塞奈吉明(Cenegermin)
塞奈吉明是DompéFarmaceutici开发的一种重组人神经生长因子(NGF),其滴眼液于2017年、2018年和2020年分别在欧洲(商品名:Sentinel)、美国(商品名:Oxervate)和中国(商品名:欧适维)获批上市,用于治疗神经营养性角膜炎。
此次,DompéFarmaceutici推出的是塞奈吉明的鼻内给药制剂,旨在绕过血脑屏障来治疗非动脉炎性前缺血性视神经病变(NAION)。
视神经病变是由视神经损伤引起的疾病,由于损伤、炎症、血流异常或遗传和退行性因素而破坏了从视网膜到大脑的视觉信号。结果是进行性或突然的视力丧失,通常影响中央或周边视力、颜色辨别力,严重时会导致永久性失明。NAION是50岁以上人群急性视神经损伤和视神经病变的最常见原因。确切发病原因尚不完全清楚,但常见的危险因素包括糖尿病、高血压、高胆固醇和吸烟。目前尚无疗法可以逆转NAION患者的视力丧失或预防恶化。
RMC-6236(daraxonrasib)
RMC-6236是Revolution Medicines开发的一款靶向RAS的口服、非共价、多选择性抑制剂,于2022年进入临床阶段。
I期研究数据显示,携带KRAS G12X突变的胰腺导管癌(PDAC)患者接受RMC-6236作为二线治疗后,客观缓解率(ORR)为29%,疾病控制率(DCR)为91%,中位无进展生存期(PFS)为8.5个月,中位总生存期(OS)为14.5个月 ,OS达到6个月的患者比例为89%;携带任何RAS突变的PDAC患者接受RMC-6236作为二线治疗后,中位PFS为7.6个月,中位OS为14.5个月,OS达到6个月的患者比例为91%。
今年5月,为推进RMC-6236的全球开发和商业化,Revolution Medicines与Royalty Pharma达成合作,获得20亿美元灵活资金。据该公司透露,针对PDAC的全球III期RASolve 302研究有望在2026年读出数据。
PDAC及其变体是最常见的一种胰腺癌类型,约占所有胰腺癌病例的92%。据统计,美国PDAC患者的5年生存率仅有3%。显然,这类患者极为需要有效的治疗药物,但目前治疗选择有限,且药物研发成功率低。
Bitopertin
Bitopertin是Disc Medicine开发的一款甘氨酸转运蛋白1(GlyT1)抑制剂,旨在调节血红素生物合成。基于两项II期研究(BEACON和AURORA)的积极结果,该公司在今年9月向FDA递交了Bitopertin用于治疗红细胞生成性原卟啉病(EPP)的新药上市申请(NDA)。两项研究均显示,Bitopertin可以显著降低有毒光活性中间体原卟啉IX(PPIX)的水平。
EPP,包括X连锁原卟啉症(XLP),是一种罕见的、使人衰弱且可能危及生命的疾病,由影响血红素生物合成的突变引起,导致PPIX水平升高。当患者暴露在阳光下时,这会引起严重的反应,其特征是难以忍受的疼痛、水肿、烧灼感以及潜在的起泡和毁容。PPIX还会在肝胆系统中积聚,可导致20-30%的患者出现胆结石、胆汁淤积和肝损伤等并发症,在极端情况下会导致肝功能衰竭。
氯胺酮
氯胺酮是一种NMDA受体拮抗剂,最早于1970年上市,可用于全身麻醉。长期以来,美国境内无氯胺酮原料药的生产商。此次CNPV被授予氯胺酮仿制药的美国本土原料药开发和生产企业PhlowCorporation。
Augmentin XR(阿莫西林+克拉维酸)
Augmentin XR是一款复方缓释片剂,包含阿莫西林和克拉维酸两种活性成分,于2002年在美国获批上市,可用于抗菌治疗。除了缓释片剂,该复方还包括注射液和干混悬剂,均由USAntibiotics公司生产。